벌써 5월의 끝자락입니다. 시간 참 빠릅니다.
끝자락은 항상 발걸음을 되돌아보게 되면서도, 새로운 시작에 대한 기대감이 동시에 교차되어 묘한 감정이 느껴질 때가 있습니다. 우리 모두 남은 2022년 하반기에 씩씩하게 잘 헤쳐나갈 수 있도록 해보아야겠습니다.
의료기기 등급별 허가심사절차(1-2등급)(의료기기 등급별 허가심사절차(1-2등급) (tistory.com)에 이어 의료기기 등급별 허가심사절차 (3-4등급)에 관하여 설명하겠습니다.
의료기기 3-4등급의 기술문서 심사는 민간심사기관에 위임하지 않고 식약처 평가원(의료기기심사부)에서 업무를 수행하고 있습니다. 이때 신청은 식약처(본부)로 하면, 접수(의료기기정책과) 및 심사(의료기기심사부)를 통해 심사결과를 통보해줍니다.

3-4등급 의료기기는 아래의 의료기기허가신고심사규정 [별표5]의 동등제품 판단기준만으로 "새로운제품", "개량제품", "이미허가인증받은제품과 동등한 제품(동등제품)"으로 판단해서는 안됩니다.
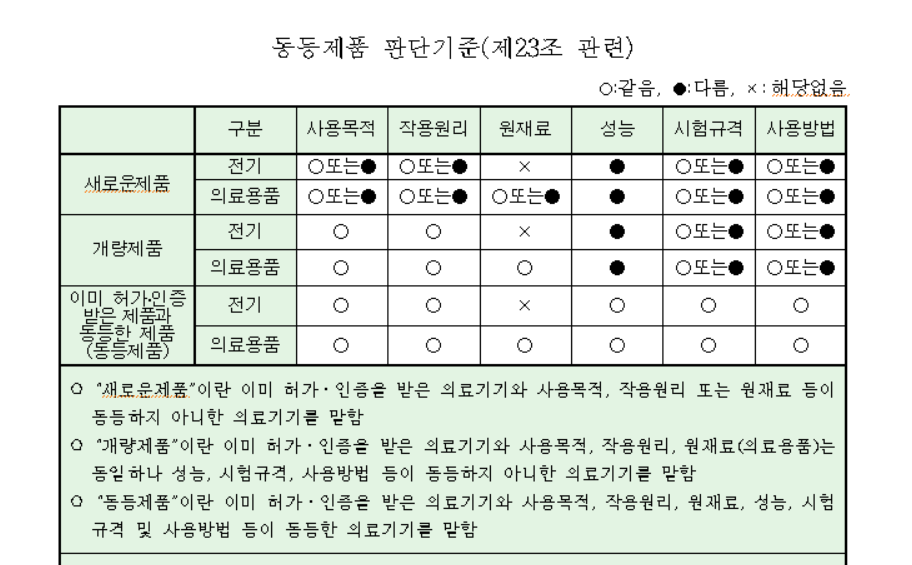
반드시 [별표7]로서 판단해야합니다.
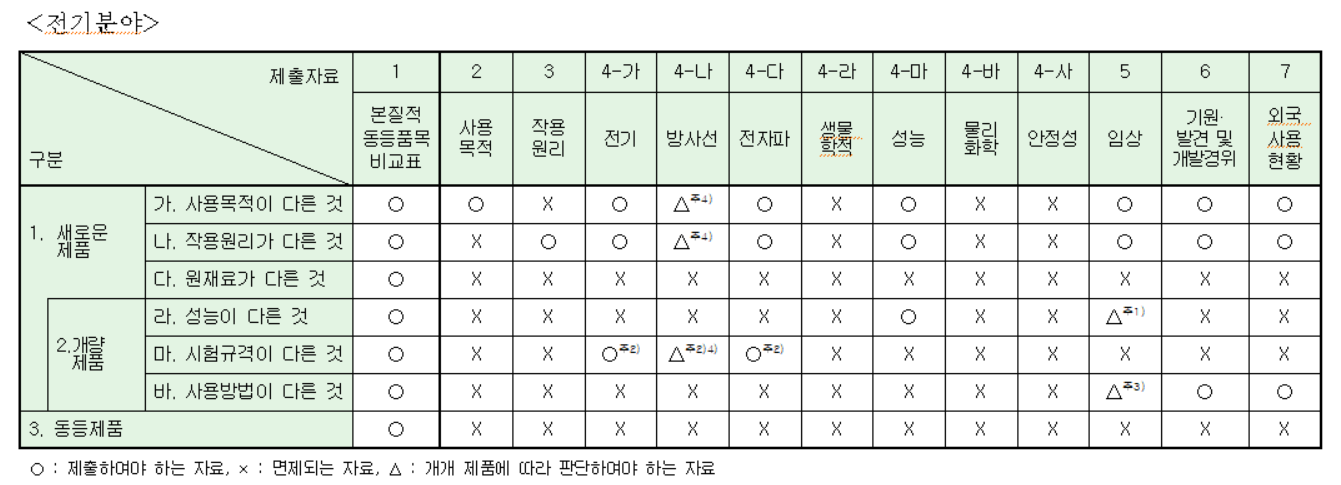
이때 허가받은 제품(기허가제품)과 우리가 인증/허가 받으려는 제품과 비교해서 차이점이 무엇인지를 판단해서 자료를 제출해야합니다. 예를 들어 우리제품이 기허가제품과 성능도 다르고 원재료도 다르다라고 하면 둘다 적용해서 보수적으로 판단하는 것이 좋습니다. 여기서의 보수적이라는 것은 필수 제출을 염두해두고 둘 중에 하나라도 O 또는 △가 있으면 반드시 자료 준비 또는 대비를 해야한다는 의미입니다.
기술문서 상세 내용 또는 작성요령은 이전 포스팅(기술문서의 이해 2 (사용목적 및 작용원리) (tistory.com))에서 연결지어 설명하겠습니다.
의료기기 허가 절차는 등급별로 아래와 같습니다.
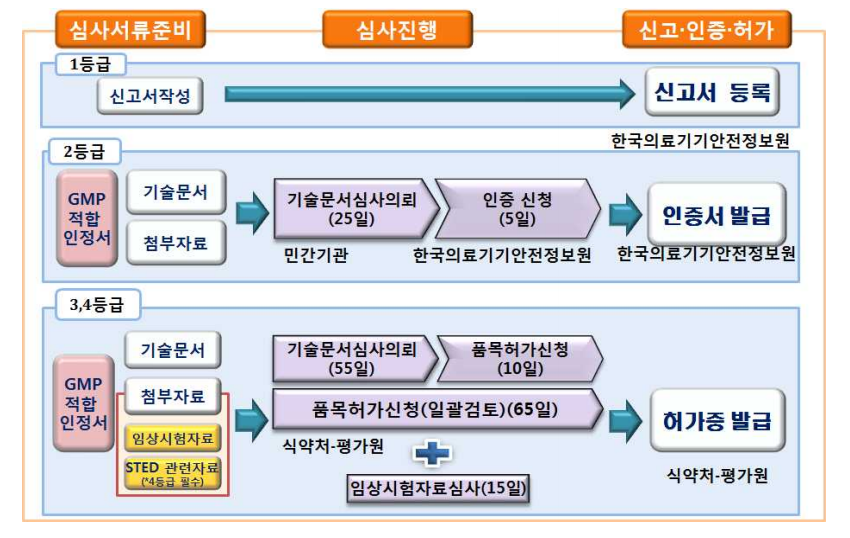
2등급~4등급에서는 크게 심사가 GMP심사와 기술문서 심사로 나뉘어지며 각각의 민원심사로 분리되어있습니다. 두가지 심사가 모두 완료가 되면 취합하여 "허가증"이 발급됩니다. 회사의 사정에 따라서 취합하여 허가증을 발급받는 경우가 있는 가하면, 조건부허가로서 GMP없이 기술문서심사를 받고 품목허가신청도 가능합니다.
4등급의 경우 STED 관련자료가 필수였으나 2019년에 완화되어서 제조공정에 한하여만 STED 필수입니다. 현재 의약품에서 말하는 CTD(국제공통기술문서, Common Technical Document)와 일맥상통합니다.
GMP는 추후에 다루어볼 계획입니다만, 간단하게 설명한다면 제조 및 품질관리기준 적합인정으로 제조업자가 의료기기의 설계, 개발, 생산, 설치 및 서비스를 제공함에 있어 적용되는 품질경영시스템 요구사항을 만족하고 있는지를 심사합니다. 즉, 얼마나 체계적이고 적합하게 품질관리를 하는가, 잘 꾸려진 시스템하에서 적절하게 생산하고 있는가라는 관점에서 제품을 만드는 제조원 또는 제조업자에 대해 심사하는 것이다 라고 이해하면 되겠습니다.
반면에 위에서 계속 설명한 기술문서 심사라는 것은 우리가 허가 또는 인증받고자 하는 제품, 해당 제품 본질에 관하여 심사하는 것이다 라고 이해하여야 하겠습니다.
이 두가지 심사인 GMP와 기술문서심사 완료가 되면 하나의 "허가증(인증서)"의 형태로서 발급이 된다라고 보면 됩니다.
'의료기기' 카테고리의 다른 글
| 기술문서의 이해 4 (성능) (4) | 2023.11.30 |
|---|---|
| 기술문서의 이해 3 (원재료) (0) | 2022.08.09 |
| 의료기기 등급별 허가심사절차(1-2등급) (3) | 2022.05.02 |
| 기술문서의 이해 2 (사용목적 및 작용원리) (2) | 2022.02.07 |
| 기술문서의 이해 1 (본질적 동등품목 비교표) (4) | 2022.01.13 |


